YMC-BioPro离子交换色谱柱是在新开发的亲水性聚合物上引入了强阳离子交换基(第四级氨基)/强阴离子交换基(硫代丙基)的,最适合于蛋白质、核酸分离的色谱柱。由高分离、高吸附量的多孔型YMC-BioPro QA / SP和适用于超高速、高分离的非多孔型YMC-BioPro QA-F / SP-F所组成。
一、YMC-BioPro离子交换色谱柱在制造过程中进行了严格的质量管理,保证能为客户提供最高品质的产品。为了使供给您的色谱柱最大地发挥其性能并能够长时间地被正确使用,请认真阅读YMC-BioPro说明书。
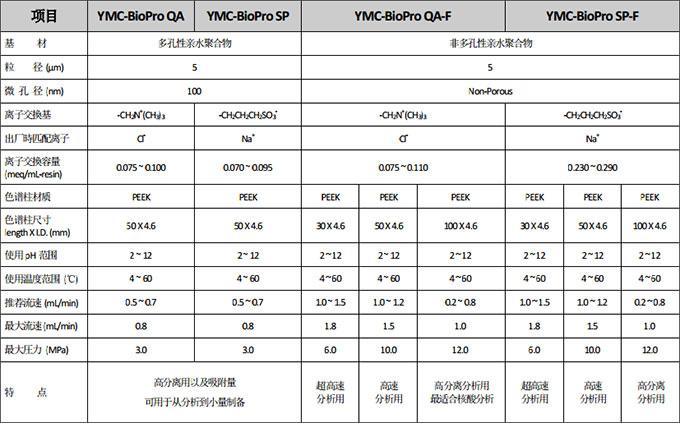
二、YMC-BioPro基本规格
三、YMC-BioPro的连接及系统设定注意事项
・色谱柱的连接采取了与waters的产品为互换共用形式。在配管的连接部分如有空隙,可能会引起漏液或色谱柱的性能(理论塔板数,峰的对称性)下降。因此要注意配管的法兰尖端长度和横截面,以免造成不必要的空隙。
・为了降低系统流路中的样品扩散(柱外扩散),进样器和色谱柱,以及色谱柱和检测器之间的配管尽可能的短一些,并请使用内径较小的(推荐内径0.15 mm以下)管路,并注意连接部分不要产生任何空隙。
・请按出峰宽对检测器的反应速度及数据处理设备上的数据采样速度进行最优化调整。特别是在 YMC-BioPro QA-F / SP-F的超高速分析上,为了能对应保留时间短、狭窄的峰形,响应值应设定在0.5sec以下,数据采样速度应在10 points/sec以上。
・请特别注意连接时不要让气泡混入柱内。
四、流动相和样品溶剂
・在产品盒内的附件COLUMN INSPECTION REPORT(检测报告)中有标示,如果色谱柱需要长期保存的话请置换为此溶剂。一周内再次使用的情况下,可在除去高浓度的盐后,使用分析用流动相保存该色谱柱。
・出厂时的内置溶剂:
YMC- BioPro QA /QA– F : 20 mM TRIS -HCl buffer (pH 8.1)
YMC- BioPro SP / SP – F : 20 mM sodium phosphate buffer (pH 6.8)
・使用时请按照色谱柱标签上的箭头方向来进行通液操作。请在色谱柱基本规格表中所表示的最大流速,最大压力以下使用。由于压力和流速的急剧变化会造成色谱柱的性能降低,因此请尽量避免发生。
・一般用20 ~ 50mM的缓冲液作为初期流动相使目标样品吸附,通过盐浓度梯度洗脱(一般把NaCl浓度在0 ~0.5M范围内调节上升)或PH梯度洗脱做到溶出分离。最终为了把流动相中没有溶出而残留在柱内的杂质去除掉,我们建议每次分析后使用含浓度为1M左右NaCl的缓冲液进行通液。
・水溶性有机溶剂最多可添加30%到洗脱液中。添加前请确认缓冲液中的盐不会发生析出。另外,可添加作为蛋白质的变性剂使用的尿素(小于8M)或盐酸胍(小于6M)、非离子性界面活性剂、阳离子性界面活性剂(仅限QA/QA-F)和阴离子性界面活性剂(仅限SP / SP-F)等。
・请避免使用含有氧化剂的溶剂作为流动相。
・样品请用和初期流动相相同组成的溶剂来进行溶解。在样品溶液的含盐浓度或pH值与流动相相异的情况下,会产生峰扩散及吸附量降低的现象。请事先通过脱盐或稀释处理,尽量与初期流动相的组成保持一致。
・为了防止筛板堵塞造成柱压上升、色谱柱劣化,流动相以及样品溶液都应预先使用0.2 ~ 0.5um的薄膜滤器进行过滤。另外建议同时使用预柱过滤网(XRPRCS02) 进行过滤。
5. 离子交换色谱柱的清洗(发现柱效发生变化时)
由于样品中的脂溶性物质或溶解性小的物质吸附在柱内,会使得保留时间、峰形发生变化,出现柱压上升等现象。在此情况下,请按以下顺序对色谱柱进行清洗。如按此方法还是不能恢复色谱柱的性能,请更换新的色谱柱。
请先把流动相置换成附件COLUMN INSPECTION REPORT(检测报告)中标示的检查洗脱液(出厂时的保存溶剂)。
然后在流动相通液的情况下,通过进样器按以下(1)到(4)的顺序将清洗溶剂各注入4-5ml(使用≧2ml的定量环会较方便)。
清洗溶剂:
(1) 0.2M 氢氧化钠水溶液/乙腈(80 / 20);
(2) 1M醋酸水溶液;
(3) 添加了非离子性界面活性剂的流动相(如0.02%Brij TM35);
(4) 添加了6M盐酸胍的流动相。
每个溶剂清洗后,请确认保留时间及峰形是否恢复。